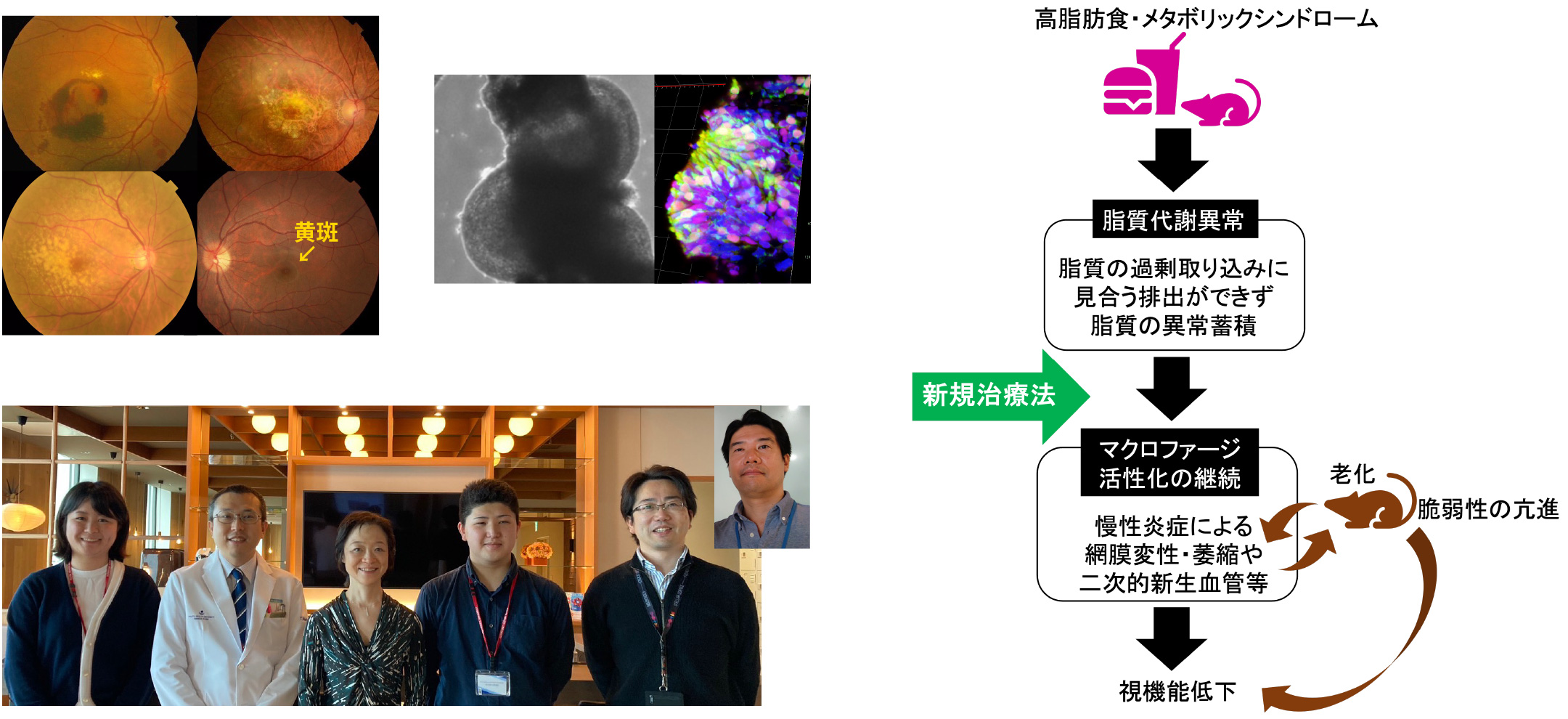
加齢黄斑変性(age-related macular degeneration; AMD)は50歳以上の1%以上が発症し、進行すると失明につながりうるため、高齢化社会においては社会問題となります。AMDの最大のリスクは老化による脆弱性であり、加えて長年の慢性炎症や酸化ストレスの蓄積による基盤病態が徐々に進行して発症します。現行の治療は終期に形成される新生血管に対する対症療法だけであり、最終的に後遺症を残すことも多くあります。早期や中期に発見されても根本治療はありません。そこで、AMDの基盤病態をさらに解明し、新しい治療ターゲットを定めて世界的に新しい治療法の開発につなげます。
これまで我々の研究室では、AMDの基盤にある慢性炎症には高脂肪食によるマクロファージの病的活性化が鍵となること、その背景には脂質代謝異常が関係することを明らかにしました (Nagai, Okano, Ozawa et al. Communications Biology 2020)。ヒトにおけるAMD発症のリスク因子には、喫煙の他に高脂肪食や肥満を始めとするメタボリックシンドローム、脂質代謝に関連する遺伝子の変化などがあることからも、脂質代謝の制御は重要といえます。その一つの方法として、同論文で我々はこれまでにマウスにおいて、アンジオテンシンⅡ 1型受容体抗剤 (angiotensin II type1 receptor blocker; ARB)の継続投与による脂質代謝制御の方法を報告しました。現在はその効果のメカニズムをさらに解明すると共に、さらなる病態メカニズムと新規治療アプローチを探索しています。
AMDを発症しない者でも、年齢と共に網膜の機能が低下することは知られています。老化と慢性炎症の関係は深く、将来的には本研究が、AMDだけでなく老化に伴う視機能低下を抑制し機能的回復させる対策につながるよう、眼の健康長寿につながるよう研究を続けています。